Los hallazgos de una pantalla a gran escala podrían ayudar a los investigadores a diseñar nanopartículas que se dirijan a tipos específicos de cáncer
Ana Trafton | Oficina de noticias del MIT
El uso de nanopartículas para administrar medicamentos contra el cáncer ofrece una forma de atacar los tumores con grandes dosis de medicamentos y, al mismo tiempo, evitar los efectos secundarios dañinos que a menudo acompañan a la quimioterapia. Sin embargo, hasta ahora, solo un puñado de medicamentos contra el cáncer basados en nanopartículas han sido aprobados por la FDA.
Un nuevo estudio del MIT y del Instituto Broad del MIT y de investigadores de Harvard puede ayudar a superar algunos de los obstáculos para el desarrollo de fármacos basados en nanopartículas. El análisis del equipo de las interacciones entre 35 tipos diferentes de nanopartículas y casi 500 tipos de células cancerosas reveló miles de rasgos biológicos que influyen en si esas células absorben diferentes tipos de nanopartículas.
Los hallazgos podrían ayudar a los investigadores a adaptar mejor sus partículas de administración de fármacos a tipos específicos de cáncer, o diseñar nuevas partículas que aprovechen las características biológicas de tipos particulares de células cancerosas.
“Estamos entusiasmados con nuestros hallazgos porque en realidad es solo el comienzo: podemos usar este enfoque para mapear qué tipos de nanopartículas son mejores para atacar ciertos tipos de células, desde el cáncer hasta las células inmunitarias y otros tipos de células de órganos sanos y enfermos. Estamos aprendiendo cómo la química de la superficie y otras propiedades de los materiales juegan un papel en la focalización”, dice Paula Hammond, profesora del Instituto MIT, directora del Departamento de Ingeniería Química y miembro del Instituto Koch para la Investigación Integrativa del Cáncer del MIT.
Hammond es el autor principal del nuevo estudio, que aparece hoy en Science. Los autores principales del artículo son Natalie Boehnke, una posdoctorado del MIT que pronto se unirá a la facultad de la Universidad de Minnesota, y Joelle Straehla, investigadora clínica Charles W. y Jennifer C. Johnson en el Instituto Koch, instructora en la Escuela de Medicina de Harvard, y oncólogo pediátrico en el Dana-Farber Cancer Institute.
Interacciones célula-partícula
El laboratorio de Hammond ha desarrollado previamente muchos tipos de nanopartículas que se pueden usar para administrar medicamentos a las células. Los estudios en su laboratorio y otros han demostrado que diferentes tipos de células cancerosas a menudo responden de manera diferente a las mismas nanopartículas. Boehnke, que estudiaba el cáncer de ovario cuando se unió al laboratorio de Hammond, y Straehla, que estudiaba el cáncer de cerebro, también notaron este fenómeno en sus estudios.
Los investigadores plantearon la hipótesis de que las diferencias biológicas entre las células podrían estar impulsando la variación en sus respuestas. Para descubrir cuáles podrían ser esas diferencias, decidieron realizar un estudio a gran escala en el que pudieran observar una gran cantidad de células diferentes que interactúan con muchos tipos de nanopartículas.
Straehla se había enterado recientemente de la plataforma PRISM del Instituto Broad , que fue diseñada para permitir a los investigadores examinar rápidamente miles de medicamentos en cientos de tipos de cáncer diferentes al mismo tiempo. Con la colaboración instrumental de Angela Koehler, profesora asociada de ingeniería biológica del MIT, el equipo decidió intentar adaptar esa plataforma para detectar interacciones entre células y nanopartículas en lugar de interacciones entre células y fármacos.
“Usando este enfoque, podemos comenzar a pensar si hay algo en la firma genotípica de una célula que prediga cuántas nanopartículas absorberá”, dice Boehnke.
Para su pantalla, los investigadores utilizaron 488 líneas de células cancerosas de 22 tejidos de origen diferentes. Cada tipo de célula tiene un «código de barras» con una secuencia de ADN única que permite a los investigadores identificar las células más adelante. Para cada tipo de célula, también hay disponibles extensos conjuntos de datos sobre sus perfiles de expresión génica y otras características biológicas.
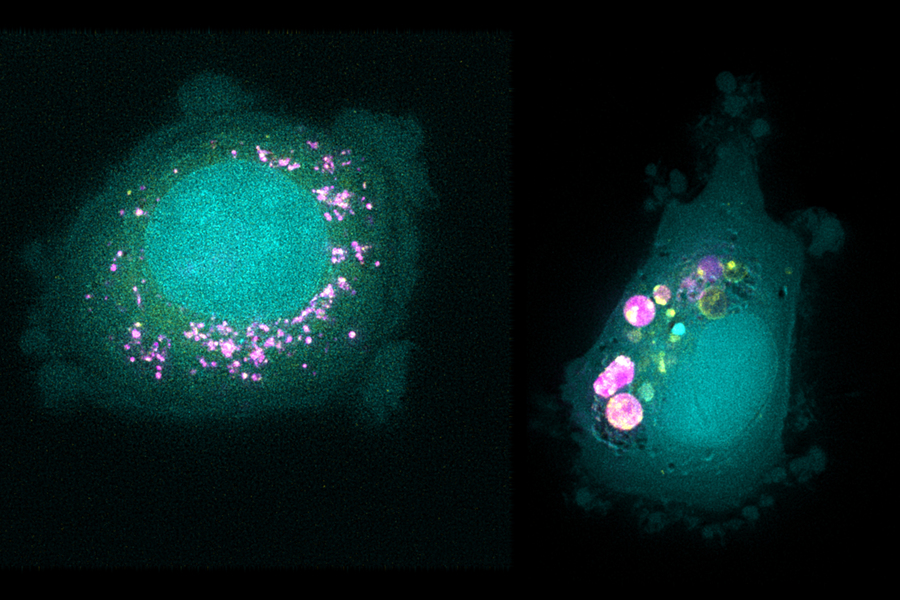
En el lado de las nanopartículas, los investigadores crearon 35 partículas, cada una de las cuales tenía un núcleo que constaba de liposomas (partículas hechas de muchas moléculas grasas llamadas lípidos), un polímero conocido como PLGA u otro polímero llamado poliestireno. Los investigadores también recubrieron las partículas con diferentes tipos de moléculas protectoras o dirigidas, incluidos polímeros como polietilenglicol, anticuerpos y polisacáridos. Esto les permitió estudiar la influencia tanto de la composición del núcleo como de la química superficial de las partículas.
Trabajando con científicos del Broad Institute, incluida Jennifer Roth, directora del laboratorio PRISM, los investigadores expusieron grupos de cientos de células diferentes a una de las 35 nanopartículas diferentes. Cada nanopartícula tenía una etiqueta fluorescente, por lo que los investigadores pudieron usar una técnica de clasificación de células para separar las células en función de la cantidad de fluorescencia que emitieron después de una exposición de cuatro o 24 horas.
Con base en estas mediciones, a cada línea celular se le asignó una puntuación que representaba su afinidad por cada nanopartícula. Luego, los investigadores utilizaron algoritmos de aprendizaje automático para analizar esos puntajes junto con todos los demás datos biológicos disponibles para cada línea celular.
Este análisis arrojó miles de características, o biomarcadores, asociados con la afinidad por diferentes tipos de nanopartículas. Muchos de estos marcadores eran genes que codifican la maquinaria celular necesaria para unir partículas, llevarlas a una célula o procesarlas. Ya se sabía que algunos de estos genes estaban involucrados en el tráfico de nanopartículas, pero muchos otros eran nuevos.
“Encontramos algunos marcadores que esperábamos, y también encontramos muchos más que realmente no han sido explorados. Esperamos que otras personas puedan usar este conjunto de datos para ayudar a ampliar su visión de cómo interactúan las nanopartículas y las células”, dice Straehla.
Absorción de partículas
Los investigadores eligieron uno de los biomarcadores que identificaron, una proteína llamada SLC46A3, para realizar más estudios. La prueba PRISM había demostrado que los niveles altos de esta proteína se correlacionaban con una absorción muy baja de nanopartículas basadas en lípidos. Cuando los investigadores probaron estas partículas en modelos de ratón con melanoma, encontraron la misma correlación. Los hallazgos sugieren que este biomarcador podría usarse para ayudar a los médicos a identificar a los pacientes cuyos tumores tienen más probabilidades de responder a las terapias basadas en nanopartículas.
Ahora, los investigadores están tratando de descubrir el mecanismo por el cual SLC46A3 regula la absorción de nanopartículas. Si pudieran descubrir nuevas formas de disminuir los niveles celulares de esta proteína, eso podría ayudar a que los tumores fueran más susceptibles a los medicamentos transportados por nanopartículas lipídicas. Los investigadores también están trabajando para explorar más a fondo algunos de los otros biomarcadores que encontraron.
Este enfoque de detección también podría usarse para investigar muchos otros tipos de nanopartículas que los investigadores no observaron en este estudio.
“El cielo es el límite en términos de otros biomarcadores no descubiertos que no hemos capturado porque no los hemos analizado”, dice Boehnke. «Esperemos que sea una inspiración para que otros comiencen a observar sus sistemas de nanopartículas de manera similar».