Decenas de laboratorios de todo el mundo se esfuerzan por crear modelos de embriones humanos para estudiar el desarrollo, la fertilidad y las terapias. Están entrando en un territorio ético inexplorado
Por Smriti Mallapaty-Nature
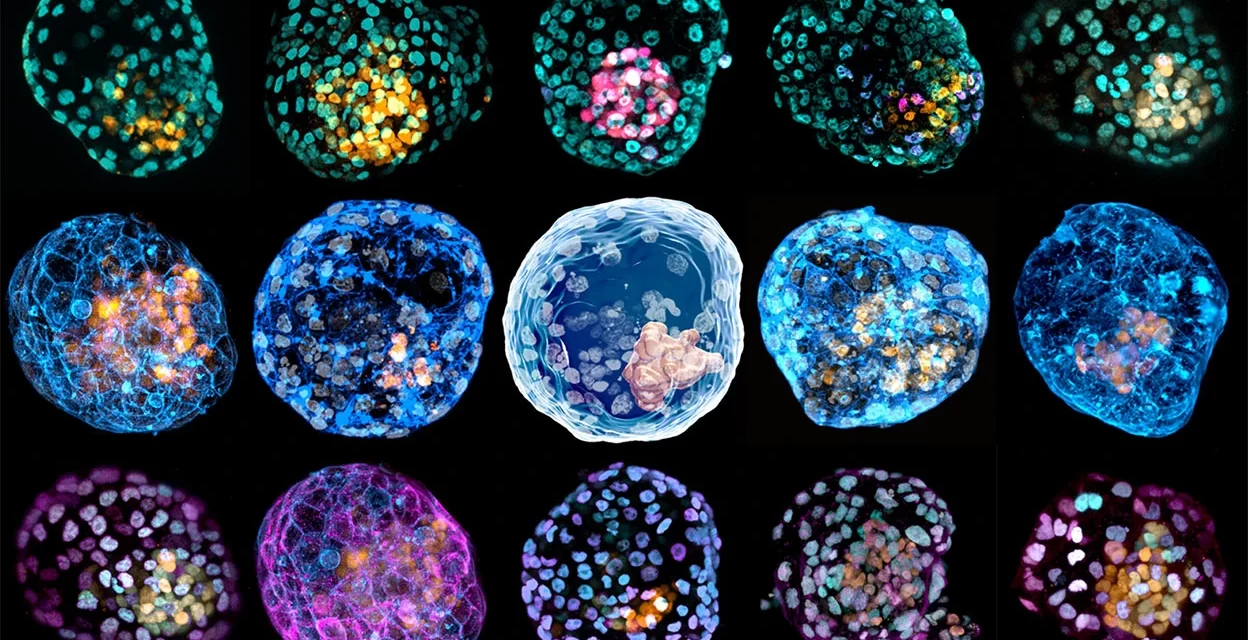
Con el microscopio, Jun Wu pudo ver varias esferas diminutas, cada una de menos de un milímetro de ancho. Parecían embriones humanos: un grupo oscuro de células rodeado por una cavidad y luego otro anillo de células.
Pero Wu, biólogo de células madre del Centro Médico de la Universidad de Texas Southwestern en Dallas, sabía que esas esferas no eran lo que parecían. Eran modelos de embriones cultivados en laboratorio y estaban lejos de ser réplicas perfectas.
Había grupos enteros de células ausentes y otras que no debían estar allí. Y Wu sabía que, con el tiempo, los modelos perecerían de forma abrupta y caótica.
Si los modelos de embriones fueran casas, detrás de la fachada habría pisos desnivelados, espejos deformantes y fantasmas en los armarios. Sin embargo, decenas de laboratorios compiten por crear la imagen más parecida a la de un embrión humano .
Hay tantos modelos como grupos que los elaboran, cada uno de los cuales recapitula aspectos ligeramente diferentes del desarrollo del embrión con la esperanza de descubrir nueva biología sobre las primeras semanas después de la concepción.
Este período de gran importancia y dramatismo “está envuelto en misterio”, dice Nicolas Rivron, biólogo del desarrollo del Instituto de Biotecnología Molecular de la Academia Austriaca de Ciencias en Viena. En el útero, estos embriones son demasiado pequeños para ser observados mediante ecografía. Y en el laboratorio, existen límites técnicos, éticos (y a menudo legales) para estudiar embriones reales fuera del cuerpo más allá de los 14 días posteriores a la concepción.
Los conocimientos adquiridos a partir de modelos embrionarios podrían ayudar a explicar por qué aproximadamente un tercio de los embriones naturales no sobreviven a sus primeras semanas. Esto podría ayudar a abordar la infertilidad, mejorar la tasa de éxito de la fertilización in vitro e incluso prevenir enfermedades que surgen en las primeras etapas del desarrollo. Los modelos también podrían utilizarse para probar la seguridad de los medicamentos para los embriones.
Pero a medida que los modelos se vuelven cada vez más complejos y alcanzan hitos simbólicos, como el primer latido del corazón, plantean cuestiones éticas complicadas . Los especialistas en ética, los reguladores y los especialistas legales se esfuerzan por seguir el ritmo de la investigación.
Mientras tanto, el campo está en plena ebullición. En febrero, los investigadores organizaron la primera reunión científica del mundo dedicada íntegramente a los modelos embrionarios . Y varios científicos han creado empresas derivadas para utilizar los modelos para desarrollar moléculas terapéuticas, probar medicamentos y mejorar los tratamientos de fertilidad. Los modelos embrionarios son «prácticamente el tema más candente en este momento», dice Insoo Hyun, consultor de bioética del Instituto Broad del MIT y Harvard en Cambridge, Massachusetts.
Espectáculo épico
El encuentro entre el óvulo y el espermatozoide desencadena un proceso de división y diferenciación celular rápido y perfectamente coordinado. En la primera semana, unas 100 células forman un círculo hueco conocido como blastocisto. Este está formado por tres grupos distintos que, con el tiempo, se transforman en el embrión, el saco vitelino de sostén y la placenta.
Luego, el embrión se implanta en el útero. A partir de las dos semanas, los embriones pasan por un proceso conocido como gastrulación, en el que las células se convierten en uno de los tres tipos de células y se organizan en capas. Estas capas se diferencian aún más en pulmones, intestinos, músculos y otros órganos, en un proceso conocido como organogénesis.
“El embrión nunca es estático”, afirma Naomi Moris, bióloga del desarrollo del Instituto Francis Crick de Londres. “Pasa por cambios enormes y dramáticos”.
Los investigadores han intentado recrear este espectáculo épico en una placa de laboratorio. Estos esfuerzos, realizados a menudo en ratones y luego en humanos, generalmente han capturado instantáneas del proceso.
En 2014, los investigadores lograron que las células madre embrionarias humanas formaran tres anillos distintos: precursores de las células que forman el embrión y la placenta 1 . Los modelos posteriores presentaban cavidades amnióticas y sacos vitelinos, y algunos eran tridimensionales. En 2020, algunos investigadores habían recapitulado un aspecto de la gastrulación 2 , en la que el embrión se alarga hasta formar una estructura similar a un tubo.
Pero muchos de los primeros estudios no serían considerados modelos de un embrión completo según los estándares actuales, dice Wu.
Modelo completo
Un hito importante se produjo en 2021, cuando el grupo 3 de Wu y otro equipo 4 publicaron modelos que se asemejan al blastocisto humano (ver ‘Desarrollo del modelo’), normalmente la etapa en la que los embriones se transfieren al útero durante la fertilización in vitro.
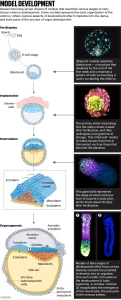
Estos modelos, llamados blastoides, contienen células que forman el embrión y aquellas que lo sostendrán, llamadas células extraembrionarias, lo que los convierte en los primeros modelos “completos” o “integrados” del embrión humano.
“No son perfectos”, afirma Marta Shahbazi, bióloga de células madre y desarrollo del Laboratorio de Biología Molecular del MRC en Cambridge, Reino Unido. Pero “son bastante buenos”.
Algunos grupos han intentado capturar etapas incluso más tempranas del desarrollo, utilizando células con la capacidad de convertirse en cualquier tipo de célula necesario para el desarrollo embrionario (la mayoría de los modelos utilizan células con capacidades más limitadas).
En 2022, Miguel Esteban, biólogo de células madre de la empresa de biotecnología BGI Cell en Shenzhen, China, y sus colegas desarrollaron un modelo que se asemeja al embrión de ocho células que normalmente se forma tres días después de la fertilización 5 . Y este junio, Du Peng, biólogo de células madre de la Universidad de Pekín en Beijing, creó imitadores de blastómeros similares que eventualmente forman blastoides sin necesidad de ser rociados con productos químicos 6 .
Escribiendo las reglas
Desde que aparecieron los primeros modelos de embriones, los especialistas en ética se han esforzado por abordar los dilemas que plantean. La Sociedad Internacional para la Investigación con Células Madre (ISSCR) elaboró unas directrices en 2021 ; muchos países están considerando sus propias directrices y legislación.
Las normas australianas son de las más estrictas del mundo. En 2020, el bioquímico José Polo, que dirige un equipo con sede en la Universidad de Monash en Melbourne y la Universidad de Adelaida, informó al organismo regulador australiano que supervisa la investigación con embriones, el Consejo Nacional de Salud e Investigación Médica, que había desarrollado blastoides y se le pidió que suspendiera el trabajo.
El regulador quería evaluar si los blastoides cumplían los criterios para ser considerados un embrión según las leyes actuales, que definen a los embriones como entidades biológicas con el potencial de desarrollarse hasta una etapa, aproximadamente a las dos semanas, en la que aparece una estructura llamada línea primitiva y la entidad avanza hacia tener un plan corporal.
Unos cinco meses después, llegó la respuesta: según la agencia, lo lograron debido a su potencial teórico para desarrollar una línea primitiva. En consecuencia, los mismos límites que se aplican a la investigación con embriones reales se aplicarían a los blastoides.
Fue un revés devastador, dice Polo. Su equipo tuvo que obtener una licencia específica para embriones, que prohíbe al grupo cultivar blastoides para estudiar etapas posteriores de la gastrulación y la organogénesis. «Creo que cometieron un error», dice Polo sobre la decisión de la agencia. Las reglas también limitan el número de blastoides que se pueden producir y requieren un consentimiento más estricto de quienes donan células para utilizarlas en ellos.
Cada país está trazando su propio camino. Algunos puntos de contraste son cómo definen los países un embrión, si esa definición se extiende a los modelos embrionarios y cuán permisivas son las reglas para la investigación. Los reguladores a menudo se guían por reglas y normas diseñadas para la investigación con embriones humanos reales cuando piensan en modelos embrionarios, dice Megan Munsie, bióloga del desarrollo y bioeticista del Instituto de Investigación Infantil Murdoch en Melbourne.
Y estos debates a menudo trascienden el mundo de la investigación y encuentran relevancia en otros ámbitos, como la salud reproductiva, el aborto, los derechos de las mujeres y la medicina regenerativa, dice Alfonso Martínez Arias, biólogo del desarrollo de la Universidad Pompeu Fabra en Barcelona, España. “Nuestra cámara de resonancia es muy grande”, dijo en una sala repleta de colegas en la reunión anual de la ISSCR en Hamburgo, Alemania, en julio.
Como los modelos embrionarios difieren en muchos aspectos de las estructuras reales, la mayoría de los países tratan a ambos de forma diferente. En España, por ejemplo, la definición de embrión se basa en la fecundación, lo que excluye a los modelos embrionarios, afirma Nienke de Graeff, bioeticista del Centro Médico de la Universidad de Leiden (Países Bajos).
Algunas definiciones se centran en el potencial del embrión para formarse o convertirse en otra cosa. La ISSCR ha dicho que, en función de su potencial, los modelos de embriones no pueden considerarse embriones, y la mayoría de los países tienen una opinión similar.
Algunos han propuesto revisar las normas relativas a los embriones reales para incluir algunos tipos de modelos embrionarios. En los Países Bajos, dice Nienke, un organismo asesor científico propuso prohibir el cultivo de los modelos más allá del equivalente a 28 días en términos de embriones reales. Francia está considerando el mismo límite. Los investigadores del Reino Unido hicieron algo un poco diferente en julio: publicaron directrices voluntarias para los modelos embrionarios que no establecen límites fijos sobre el tiempo durante el cual pueden cultivarse. Las directrices podrían conducir eventualmente a la aprobación de una legislación vinculante, como sucedió con directrices voluntarias similares en el Reino Unido sobre la investigación con embriones hace varias décadas.
Sin embargo, las directrices del Reino Unido y las directrices ISSCR de 2021 prohíben la transferencia de modelos de embriones humanos al útero, y varios otros países, incluidos Suecia y Japón, están considerando introducir restricciones similares.
La ciencia se acelera
Mientras tanto, la ciencia sigue avanzando a tal ritmo que los reguladores tienen mucho que hacer. En junio de 2024, la ISSCR anunció que había creado un grupo de trabajo para evaluar el estado de la ciencia y revisar las directrices anteriores, a la luz de los modelos publicados desde 2021.
En 2023, alrededor de media docena de equipos describieron modelos que recapitulan el desarrollo de los embriones justo después de la implantación. Dos modelos en particular recibieron una amplia cobertura mediática: uno de Magdalena Zernicka-Goetz, bióloga del desarrollo del Instituto Tecnológico de California en Pasadena, y otro de Jacob Hanna, biólogo de células madre del Instituto de Ciencias Weizmann en Rehovot, Israel. Se los describió como modelos completos post-implantación, pero ese título ha sido objeto de acalorados debates.
“No son modelos completos”, dice Rivron. El del grupo 7 de Zernicka-Goetz no tiene células que se comporten como trofoblastos, que proporcionan nutrición al embrión, y aunque el 8 de Hanna sí contiene una capa similar a la del trofoblasto, no está tan organizado como el modelo real, dicen los investigadores.
“Es casi como un concurso de belleza: qué modelo se ve mejor”, dice Jianping Fu, bioingeniero de la Universidad de Michigan en Ann Arbor. “Hay mucho entusiasmo, pero al mismo tiempo, hay cierto entusiasmo en este campo en este momento”.
Algunos investigadores cuestionan el valor de perseguir un modelo completo. Es un “acto de equilibrio bastante exquisito”, dice Hyun. Los investigadores quieren modelos que se parezcan a un embrión lo suficiente como para proporcionar una visión real del desarrollo humano, pero no tan de cerca como para no poder distinguir entre los dos, y así arriesgarse a que se restrinja su trabajo. “Queremos patinar lo más cerca posible del borde, sin caernos”, dice.
Algunos investigadores intentan evitar este dilema ético introduciendo deliberadamente cambios en sus modelos embrionarios que harían imposible que el modelo diera lugar a un organismo. Por ejemplo, Hanna ha empezado a trabajar en modelos en los que se han desactivado los genes implicados en el desarrollo del cerebro y del corazón. Ha deducido de conversaciones con líderes cristianos y judíos de su comunidad que un modelo embrionario carente de tejido cerebral o cardíaco no se consideraría una forma de persona.
Fu ha descrito un modelo 9 que, según él, alivia algunas de las cargas éticas porque, aunque alcanza la gastrulación, lo hace sin formar primero la línea primitiva.
Los investigadores afirman que estos modelos pueden ser reveladores y útiles. Uno de ellos, publicado por primera vez en diciembre pasado, ha generado entusiasmo debido a lo bien que refleja algunos aspectos de los embriones reales 10 , así como por sus implicaciones directas para la clínica. Cuando Mo Ebrahimkhani, un bioingeniero de células madre de la Universidad de Pittsburgh, Pensilvania, y sus colegas cultivaron modelos 3D en una placa, notaron la aparición de diminutas islas de sangre. Esas islas contenían los primeros progenitores de células sanguíneas, incluidas células inmunes conocidas como macrófagos, células productoras de plaquetas y células que contienen hemoglobina. Como ha descubierto Ebrahimkhani en un trabajo inédito, estos modelos podrían usarse para producir grandes cantidades de células madre sanguíneas, que podrían ser útiles para trasplantes en personas con cáncer o enfermedades genéticas.
Fabricación de órganos
A las tres semanas, aproximadamente, el embrión inicia el trascendental proceso de crecimiento de los órganos, que dura más de un mes. Varios equipos se han centrado en aspectos de esta organogénesis, creando modelos que se asemejan solo a partes del embrión; esto tiene potencialmente menos restricciones éticas que modelar la estructura completa.
Uno de esos modelos 11 recapitula el proceso rítmico por el cual el cuerpo forma segmentos repetitivos conocidos como somitas, que dan origen a las vértebras. Y a principios de este año 12 , el equipo de Fu describió un modelo del tubo neural, el progenitor del sistema nervioso central, con un tesoro de células, incluidas las precursoras de algunas neuronas.
Pero incluso estos modelos no están libres de controversia: aquellos que contienen células nerviosas plantean cuestiones éticas en torno al surgimiento de la sensibilidad, dice Hyun.
La próxima frontera para los modelos similares a embriones es colocarlos en entornos que se asemejen más al útero y estudiar cómo interactúan los embriones con su revestimiento. Los investigadores han demostrado que los blastoides colocados en células que forman el revestimiento del útero pueden penetrar y fusionarse correctamente. El cocultivo de modelos de embriones con este tejido materno podría ayudar a que los modelos se desarrollen como lo harían los embriones naturales.
Algunos científicos han ido incluso más allá, utilizando células de otros animales, incluidos primates no humanos. Por ejemplo, en un trabajo inédito, Liu Zhen, biólogo del desarrollo del Instituto de Neurociencia de la Academia China de Ciencias en Shanghái, ha cultivado blastoides de mono en una placa durante el tiempo suficiente para alcanzar la organogénesis temprana.
En 2023, Liu transfirió blastoides a ocho monos, tres de los cuales experimentaron el aumento hormonal observado al comienzo del embarazo 13 . Los blastoides formaron sacos de gestación, pero luego dejaron de desarrollarse. Los blastoides de vaca y ratón transferidos a sus respectivas especies tampoco sobreviven mucho tiempo.
Actualmente no existen normas que prohíban la transferencia de modelos de embriones no humanos a animales vivos, con excepción de los humanos, pero a Hyun le preocupa que si dichas transferencias dan lugar a un nacimiento vivo, eso provocará una reacción negativa contra la investigación y tendrá un efecto perjudicial en los estudios que utilizan modelos de embriones humanos. El salto intelectual del mono al ser humano es fácil de dar, afirma. «En realidad, no es necesario realizar el experimento con humanos para tener una preocupación bastante importante».
¿Cuándo es un embrión?
La mayoría de los investigadores coinciden en que los modelos de embriones humanos actuales no se parecen en nada a los modelos reales. El principal desafío para los investigadores que están desarrollando directrices es determinar «cuándo un modelo de embrión se consideraría equivalente a un embrión», dice Amander Clark, biólogo de desarrollo y de células madre de la Universidad de California en Los Ángeles, que preside el grupo de trabajo de la ISSCR sobre modelos de embriones.
Dado que las normas éticas prohíben la transferencia de modelos de embriones a un útero para ver si pueden dar lugar a un organismo, los investigadores están ideando otras pruebas para evaluar su potencial. Algunos grupos están desarrollando herramientas para comparar mejor los modelos de embriones con los embriones reales, por ejemplo, observando los perfiles de ARN de las células. Pero incluso estos ejercicios de expresión genética pueden pasar por alto información clave, dice Hanna, como la posición de las células en un embrión.
Según Fredrik Lanner, biólogo de células madre y desarrollo del Instituto Karolinska de Estocolmo, evaluar y mejorar los modelos es importante para la ciencia y la ética. Si los modelos no son buenos, no son útiles, afirma. «Es realmente crucial que no perdamos el tiempo con modelos malos».
Ese establecimiento de estándares es especialmente importante ahora que el campo comienza a ofrecer información real sobre el desarrollo embrionario temprano. Ya ha habido algunas sorpresas, dice Moris. La más notable es la capacidad de las células para cambiar de personalidad (su plasticidad) y su capacidad de autoorganizarse, a menudo sin la ayuda de tejido extraembrionario.
Algunos modelos incluso están revelando nuevos fenómenos. Los investigadores saben desde hace tiempo que, en algunos mamíferos, los embriones que son fecundados en verano «hibernan» y reinician su desarrollo más tarde, de modo que las crías nacen en primavera. En un trabajo inédito, Rivron y sus colegas han logrado convencer a los blastoides humanos para que alcancen este estado de desarrollo suspendido.
Pero hasta ahora, dice, los modelos embrionarios no han conducido a descubrimientos científicos de valor social, y no está claro qué modelos ayudarán a los investigadores a llegar allí.
“En el pasado ha habido muchos debates, discusiones, sobre todo dramas”, en la línea de “mi modelo es mejor que el tuyo”, dice Wu. La realidad es que todos los modelos son imperfectos, pero todos son útiles, dice. Sólo depende de cuál sea la pregunta.
Naturaleza 633 , 268-271 (2024)
doi: https://doi.org/10.1038/d41586-024-02915-3
Referencias
Warmflash, A., Sorre, B., Etoc, F., Siggia, ED y Brivanlou, AH Nature Methods 11 , 847–854 (2014).