Los investigadores están administrando medicamentos a personas sanas con la esperanza de eliminar las proteínas tóxicas del cerebro y prevenir la neurogeneración
(nature)-Cada dos semanas, una enfermera visita a Marty Reiswig, de 43 años, en Denver, Colorado, y le inyecta un fármaco experimental llamado gantenerumab. Todos los meses, Reiswig conduce a la ciudad para hacerse un escáner cerebral para asegurarse de que la droga no haya causado ninguna hemorragia. Y todos los años vuela a St Louis, Missouri, para cuatro días de escáneres cerebrales, punciones lumbares, análisis de sangre y pruebas exhaustivas de su memoria y capacidad de razonamiento.
Reiswig está en forma y saludable y dirige dos negocios locales. Pasa por todo esto porque tiene una rara mutación genética que casi garantiza que desarrollará la enfermedad de Alzheimer de inicio temprano. Espera que el ensayo clínico internacional del que ha sido parte durante nueve años pueda prevenir, o al menos retrasar, la aparición de síntomas que de otro modo surgirían en unos pocos años.
“Siempre hago lo mejor que puedo para brindarles a los investigadores todo lo que puedo, incluso si resulta que no me ayuda a mí, podría ayudar a mis hijos”, dice.
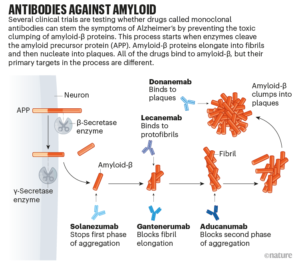
El ensayo es uno de varios que intentan comprender si tratar la causa raíz del Alzheimer antes de que comiencen los síntomas podría ser la mejor manera de manejar una enfermedad que cobra un precio tan alto. Los medicamentos bajo escrutinio son todos anticuerpos que se han desarrollado para atacar y eliminar las proteínas amiloide-β en el cerebro, que se obstruyen en masas tóxicas llamadas placas (ver ‘Anticuerpos contra amiloide’). Estos medicamentos son del mismo tipo que el aducanumab, fabricado por Biogen en Cambridge, Massachusetts, que fue aprobado provisionalmente el año pasado por la Administración de Drogas y Alimentos de los EE. UU. (FDA) para el tratamiento del Alzheimer leve, en gran parte debido a su capacidad para eliminar amiloide-β.
Y debido a que estas proteínas tóxicas son una característica de varios tipos de demencia, estos estudios de anticuerpos también podrían ofrecer pistas sobre cómo tratar a los 55 millones de personas en todo el mundo que tienen estas afecciones, dice el neurólogo Paul Aisen de la Universidad del Sur de California en San Diego. , quien es líder del Consorcio de Ensayos Clínicos de Alzheimer de EE. UU. La mayoría de las demencias aparecen después de los 65 años; todos han demostrado ser obstinadamente incurables. De más de 100 ensayos en todo el mundo, la mayoría tiene como objetivo tratar los síntomas de la enfermedad en lugar de su causa raíz.
Pero Aisen prevé un futuro, tal vez solo dentro de una década, en el que gran parte de la carga de la enfermedad de Alzheimer en realidad podría prevenirse. “Nos dirigimos hacia la detección de personas de mediana edad en adelante con análisis de sangre y el tratamiento de aquellos que muestran anomalías amiloides con medicamentos que reducen la generación de placas amiloides”, dice. «Soy optimista.»
Mucho tiene que salir bien para que esta perspectiva esperanzadora se convierta en realidad. Los grandes ensayos clínicos tendrán que demostrar que estas terapias funcionan, y los medicamentos para eliminar el amiloide tendrán que demostrar que son seguros y asequibles. Después de décadas de reveses y ensayos clínicos fallidos, algunos investigadores de la demencia prefieren expresar cautela. “El campo está asumiendo enormes riesgos al participar en estudios que pueden costar miles de millones de dólares”, dice el neurólogo David Knopman de la Clínica Mayo en Rochester, Minnesota.
Tomará un tiempo para que surjan las respuestas. Algunos ensayos de prevención de la enfermedad de Alzheimer recién están comenzando, y algunos en curso podrían extenderse hasta la próxima década.
Llegar temprano
Era 1986 cuando Carol Jennings en Nottingham, Reino Unido, le escribió una carta al genetista John Hardy preguntándole si podría serle útil en su investigación. Al igual que Reiswig, Jennings tenía muchos familiares que sucumbieron a la demencia de aparición temprana. El equipo de Hardy, ahora en el University College London, estaba interesado en la genética del Alzheimer e invitó a la familia Jennings a donar sangre para su proyecto.
Unos años más tarde, el equipo identificó una mutación compartida por los familiares afectados 1 . Estaba en un gen que codifica una proteína grande que se encuentra en las membranas de las neuronas, la proteína precursora de amiloide (APP).
La APP en el cerebro se divide en amiloide-β y otras cadenas cortas de proteína amiloide mediante un conjunto de enzimas. En cerebros sanos, estos péptidos amiloides pueden cumplir funciones útiles, pero con el tiempo pueden acumularse, tal vez porque el sistema molecular del cerebro para eliminarlos pierde eficiencia, y se agrupan en placas. En alguien con una mutación en el gen que codifica para APP, las proteínas beta-amiloides son más pegajosas o más profusas, y la enfermedad se manifiesta antes que en las personas que no tienen la mutación.
Esta es la base de la hipótesis amiloide de la enfermedad de Alzheimer, formulada por primera vez por Hardy y sus colegas después de descubrir una mutación APP que causa la enfermedad. De acuerdo con esa teoría, prevenir el evento desencadenante de la acumulación de amiloide-β podría retrasar el proceso de la enfermedad, o incluso evitar que suceda en primer lugar.
Las compañías farmacéuticas y biotecnológicas se dedicaron a atacar el sistema amiloide, desarrollando medicamentos para bloquear las enzimas que escinden APP o creando anticuerpos contra los péptidos amiloide-β. Pero sus medicamentos bombardearon continuamente en los ensayos clínicos. Se suspendieron cinco ensayos clínicos de fase III de un fármaco que bloquea una enzima que corta el amiloide, la β-secretasa, debido a los efectos secundarios que empeoraron temporalmente la cognición. Los bloqueadores de otra enzima, la γ-secretasa, actuaron de la misma manera. Una y otra vez, los ensayos de anticuerpos diseñados para adherirse y unirse al amiloide-β no lograron mejorar los síntomas clínicos de las personas . Al menos una importante empresa farmacéutica, Pfizer, abandonó el campo del alzhéimer en 2018.
Los fracasos en serie dividieron a la comunidad investigadora en campos. Un campo argumentó que si la orientación del amiloide no había funcionado, entonces la hipótesis del amiloide debía estar equivocada. Knopman acepta que el procesamiento de APP es parte del proceso de iniciación de la enfermedad, pero dice que no se ha probado el papel de amiloide-β. “Es plausible, por ejemplo, que otros productos de división de APP sean más importantes para el proceso de la enfermedad”, dice.
El otro campo argumentó que los ensayos habían sido mal diseñados, en particular porque reclutaron a personas que ya habían comenzado a mostrar signos tempranos de la enfermedad de Alzheimer.
“El hecho es que, para optimizar el impacto potencial de la eliminación de amiloide, es necesario hacerlo lo antes posible”, dice Aisen. La acumulación de amiloide-β comienza su lenta y silenciosa campaña de destrucción en el cerebro muchos años antes de que su daño sea lo suficientemente extenso como para causar síntomas, dice. “La duración total de la enfermedad de Alzheimer es de más de 25 años, y los ensayos solo se realizaron en la última década, cuando hay un empeoramiento constante de la neurodegeneración”.
Los estudios en animales respaldan esta idea. En ratones que fueron genéticamente alterados para sobre expresar APP, el tratamiento de animales jóvenes con aducanumab antes de que los depósitos de amiloide-β fueran detectables resultó en reducciones significativas en los depósitos y menos signos de enfermedad en el cerebro seis meses después .
Cuando la FDA tomó la controvertida decisión de aprobar el aducanumab de Biogen en junio del año pasado , estaba reconociendo este panorama a largo plazo: que la capacidad del fármaco para eliminar el amiloide-β hacía probable que pudiera reducir los síntomas de la enfermedad de Alzheimer en el futuro. Los grandes ensayos controlados con placebo de aducanumab de Biogen en personas con alzhéimer leve no habían mejorado de manera inequívoca sus síntomas clínicos, pero el fármaco hizo un buen trabajo al eliminar las placas amiloides de sus cerebros. La agencia declaró que aducanumab fue el primer tratamiento en afectar la causa biológica de la enfermedad.
La decisión enfureció a muchos investigadores que afirmaron que la FDA había reducido sus estándares. (Knopman renunció al comité asesor de la FDA por este tema). Pero en los meses siguientes, surgieron más datos de otros ensayos de diferentes medicamentos, que mostraban tendencias hacia una modesta desaceleración del deterioro cognitivo a medida que se eliminaba el amiloide-β, así como reducciones en otros biomarcadores de la progresión de la enfermedad de Alzheimer, como la acumulación de una proteína llamada tau. Más tarde ese año, la agencia puso tres anticuerpos más en un proceso de revisión acelerada : el gantenerumab de Genentech-Roche, el lecanemab de Biogen-Eisai y el donanemab de Eli Lilly. De manera similar a aducanumab, se ha demostrado que los tres eliminan las placas en los primeros ensayos.
“Estos medicamentos son grandes, grandes cambios en el juego”, dice el neurocientífico Bart de Strooper, director del Instituto de Investigación de la Demencia del Reino Unido en el University College London. “Permitirán probar definitivamente la hipótesis del amiloide”.
Muchos investigadores están de acuerdo en que la mejor prueba de la hipótesis, y la mejor manera de detener la enfermedad, es administrar a las personas estos medicamentos temprano, sin esperar a que los síntomas de Alzheimer se presenten primero.
Tiempo lo es todo
Según Hardy, los diseñadores incluso de los primeros ensayos podrían haberse dado cuenta de que estaban reclutando demasiado tarde en la enfermedad. “A través del retrospectoscopio, estaba claro: los datos ya estaban allí”, dice. En la década de 1980, el patólogo George Glenner de la Universidad de California en San Diego y sus colegas descubrieron que las personas con síndrome de Down desarrollaban demencia relativamente jóvenes 3 .
Sugirieron que esto se debía a que las personas con síndrome de Down tienen un cromosoma 21 adicional (donde se encuentra el gen APP ). Sus estudios post-mortem 4 mostraron que las placas se desarrollaron muchos años antes que los síntomas cognitivos.
El campo no ignora la importancia de encontrar tratamientos para el Alzheimer sintomático, dice Aisen. Pero los investigadores clínicos ahora están prestando más atención a los ensayos de medicamentos para el tratamiento de la enfermedad de Alzheimer presintomática. Sin embargo, no es fácil encontrar participantes para tales ensayos. Las personas deben ser asintomáticas, pero es muy probable que comiencen a desarrollar síntomas en una escala de tiempo medible. Hay dos enfoques para identificar a estos individuos: encontrar personas como Reiswig con una rara predisposición genética, o personas en la población general con un alto riesgo de desarrollar Alzheimer debido a la presencia de amiloide-β en sus cerebros.
Para identificar los casos genéticos raros, el Instituto Nacional sobre el Envejecimiento (NIA) de EE. UU. en Bethesda, Maryland, financió el lanzamiento de la Red de Alzheimer de herencia dominante (DIAN) en 2008. Ahora incluye a más de 600 personas de 20 países, lo que representa alrededor de 300 familias que tienen mutaciones en uno de los tres genes asociados con el Alzheimer de inicio temprano. Cada miembro de la familia tiene un 50% de posibilidades de heredar una mutación.
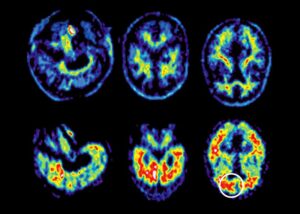
La red reunió rápidamente a más socios de financiación e investigación, y comenzó a inscribir a las familias, incluida la de Reiswig, en un programa de observación. Los investigadores realizaron tomografías por emisión de positrones (PET, por sus siglas en inglés) del cerebro para detectar amiloide-β y otros biomarcadores de la enfermedad de Alzheimer a intervalos regulares, y compararon a los miembros de la familia que portaban el gen con los que no. También anotaron cuándo tendían a comenzar los síntomas en cada familia. El informe de 2018 de la red confirmó que los primeros signos de anomalías de amiloide ocurren hasta 25 años antes de que comiencen los síntomas 5 .
El consorcio DIAN comenzó una prueba de siete años de anticuerpos de unión a amiloide en 2012. Su objetivo era retrasar el progreso de la enfermedad en personas que no tienen síntomas cognitivos pero que han comenzado a desarrollar los principales marcadores de la enfermedad de Alzheimer (placas amiloides) en sus cerebros. . El ensayo reclutó a 194 participantes en varias etapas de su condición y los dividió en grupos para recibir uno de los dos anticuerpos, gantenerumab o solanezumab, o un placebo.
Pero los resultados del ensayo, anunciados en 2020, fueron decepcionantes. El ensayo no pudo demostrar que los medicamentos pudieran retardar el deterioro cognitivo; aunque hubo un pequeño deterioro en los participantes presintomáticos tratados, también hubo un pequeño deterioro en el grupo de
placebo 6 . “Eso significaba que simplemente no podíamos decir si los medicamentos eventualmente ayudarían o no a una población asintomática”, dice Randall Bateman de la Facultad de Medicina de la Universidad de Washington en St. Louis, quien dirige la Unidad de Ensayos DIAN que realizó el estudio.
Aún así, uno de los anticuerpos, ganterumab, tuvo un impacto notable en los marcadores biológicos de la enfermedad. No solo redujo las placas amiloides, sino que también redujo los niveles de proteína tau y de otro marcador de neurodegeneración, una proteína neuronal que aparece en la sangre.
Estos resultados animaron a Bateman y al consorcio DIAN a seguir estudiando gantenerumab durante otros tres años, descartando los grupos de solanezumab y placebo, pero permitiendo a los participantes de esos grupos cambiar a gantenerumab y haciéndoles saber qué fármaco estaban tomando.
Eso le presentó a Reiswig un dilema. Cuando originalmente se le hizo la prueba de la mutación del gen, decidió no ser informado del resultado. Pero la extensión del estudio solo estaba disponible para portadores de mutaciones, por lo que una solicitud para participar revelaría automáticamente su estado genético. “Decidí que era hora de saberlo, pero planeé las cosas con cuidado”, dice. Se retiró a un alquiler de vacaciones en Colorado con su esposa para recibir la llamada telefónica de su asesor genético. “No quería averiguarlo en mi propia casa, eso era al menos algo sobre lo que quería tener control”. Reiswig lloró cuando supo que portaba la mutación y decidió que su única oportunidad era continuar con la prueba.
El año pasado, el consorcio decidió intentar tratar a personas sin síntomas cognitivos y sin placas en el cerebro. “Realmente va a ser la última prueba de prevención de la enfermedad de Alzheimer”, dice Bateman. En los próximos meses, el equipo planea comenzar a reclutar 160 portadores de mutaciones, algunos de tan solo 18 años, que no se espera que desarrollen síntomas hasta dentro de 11 a 25 años. El ensayo controlado con placebo durará cuatro años y controlará el estado amiloide de las personas a intervalos regulares. Luego pasará a un ‘estudio de etiqueta abierta’ durante algunos años más: el grupo de placebo se abandonará y todos los participantes recibirán el fármaco de prueba. En ese momento, también medirá otros biomarcadores de progresión de la enfermedad.
Sería poco práctico realizar el ensayo durante las décadas que los participantes podrían tardar en desarrollar síntomas, dice Eric McDade, investigador principal del ensayo en la Universidad de Washington en St. Louis. En cambio, el equipo monitoreará los cambios en los biomarcadores, como el amiloide-β y tau, que ahora se sabe que predicen la aparición de síntomas
durante el largo período silencioso de la enfermedad. “Cuantos más de estos otros biomarcadores podamos alterar, mayor será la probabilidad de que podamos compensar o al menos retrasar significativamente el inicio”. Los investigadores continuarán monitoreando a tantos participantes como sea posible después de la segunda fase del ensayo, dice.
Fuera del consorcio DIAN, se están realizando otros ensayos para el Alzheimer de inicio temprano, probando medicamentos en personas que ya tienen cierta acumulación de amiloide. Genentech-Roche está estudiando a individuos de una familia numerosa en Colombia, la mitad de los cuales portan una mutación patológica en un gen que codifica parte de una de las enzimas secretasas que cortan el amiloide. Su prueba del fármaco crenezumab finalizará este año. Los estudios también se están preparando para probar los medicamentos para el Alzheimer en personas con síndrome de Down.
Detener los síntomas
El segundo enfoque de los ensayos preventivos es identificar a aquellos en la población general que tienen un alto riesgo de desarrollar Alzheimer de inicio tardío. La Iniciativa internacional de neuroimagen de la enfermedad de Alzheimer, una asociación público-privada con sede en la Universidad de California, San Francisco, rastrea los biomarcadores de la enfermedad de Alzheimer en muchos cientos de personas a lo largo del envejecimiento normal y en todas las etapas de la enfermedad. Sus datos muestran que alrededor de un tercio de las personas cognitivamente normales mayores de 65 años tienen placas de amiloide en el cerebro, y que más del 85 % de ellas desarrollarán síntomas de la enfermedad de Alzheimer en un plazo de 10 años 7 .
Sobre esta base, se están realizando tres grandes ensayos clínicos controlados con placebo, cada uno de los cuales recluta a más de 1000 personas que están cognitivamente en forma pero tienen placas cerebrales, como se ve en la tomografía por emisión de positrones. Cada ensayo está probando un anticuerpo diferente. Los tres funcionarán durante cuatro años, momento en el cual el deterioro cognitivo suele ser medible después de que las placas comienzan a acumularse.
El instituto de Aisén está coordinando el ensayo A4 – Tratamiento antiamiloide en el Alzheimer asintomático – que está probando el fármaco de Lilly solanezumab. Los resultados se esperan para el próximo año. Aisen también codirige el ensayo AHEAD 3-45, que comenzó en 2020 y está probando lecanemab. Ese mismo año, Lilly comenzó un ensayo llamado Alz 2 con donanemab. Y este año, Roche está lanzando su propio ensayo de fase III con gantenerumab, que tendrá una duración de seis años.
El costo de tales juicios “normalmente es de cientos de millones de dólares”, dice Aisen. Solo reclutar a los 1169 participantes en el ensayo A4 requirió alrededor de 4500 tomografías PET, cada una con un costo promedio de US$7000. “Pero los costos para la sociedad de esta enfermedad en términos de sufrimiento, mortalidad e impacto económico justifican enormes inversiones en un tratamiento eficaz”, dice.
En los últimos años, ha habido un progreso sustancial en el desarrollo de biomarcadores de la enfermedad de Alzheimer basados en la sangre más simples . Dos de estos ensayos de prevención están utilizando tales biomarcadores para ayudar a seleccionar personas para la prueba de PET, eliminando el costo de las tomografías por emisión de positrones y las molestias para los participantes. Un biomarcador mide la proporción de dos formas ligeramente diferentes de amiloide-β y otro mide una molécula relacionada con tau.
Hasta ahora, todos los ensayos preventivos utilizan anticuerpos contra el amiloide-β. Estos medicamentos tienen dos desventajas. Pueden tener efectos secundarios: pequeñas hemorragias cerebrales o hinchazones, que en su mayoría son inofensivas, pero que pueden ser graves. Y son caros. Biogen fijó inicialmente el precio de un año de tratamiento con aducanumab en 56.000 dólares, aunque lo redujo a la mitad en diciembre de 2021.
Pero el campo está pensando en revisar medicamentos más simples de moléculas pequeñas, que serían mucho más baratos de producir que las terapias basadas en anticuerpos. Algunas compañías están comenzando a considerar revisar las enzimas secretasas, dice Aisen, tal vez modificando la estructura de las moléculas bloqueadoras de enzimas que fallaron en los primeros ensayos, o encontrando mejores formas de administrarlas.
Causas complejas
Los investigadores en el campo son conscientes de que abordar la demencia también requiere un esfuerzo más allá del amiloide-β. “La enfermedad de Alzheimer es más compleja”, dice el neurobiólogo Roger Nitsch, uno de los desarrolladores originales de aducanumab en la Universidad de Zúrich, Suiza. “El amiloide es una neurotoxina de combustión muy lenta que inicia la enfermedad, pero las células cerebrales, incluidas las que se conectan a los vasos sanguíneos y las células del sistema inmunitario, se defienden”. Habrá más formas de atacar la enfermedad establecida, dice. Además, solo alrededor de dos tercios de todas las demencias son del tipo Alzheimer, y los estudios post-mortem muestran que la mitad de estas tienen una patología mixta: los cerebros contienen otras proteínas tóxicas además de amiloide y tau, o signos de daño en los vasos sanguíneos. 8 _
Los ensayos de prevención son importantes y prometedores, dice el director del NIA, Richard Hodes, “pero no nos vamos a dar por vencidos con las personas que ya tienen la enfermedad”. Debido a que probablemente habrá múltiples contribuyentes a la demencia, incluso en el mismo individuo, se necesitará una variedad de tratamientos, dice. El NIA está financiando 72 ensayos clínicos para la demencia, probando medicamentos dirigidos a varios objetivos. Algunos, por ejemplo, apuntan a bajar la presión arterial para reducir el riesgo de que se rompan pequeños vasos sanguíneos en el cerebro; otros apuntan a tau. Solo 20 amiloide objetivo. El NIA también apoya al menos 120 ensayos para estudiar el impacto de las intervenciones no farmacológicas, como el entrenamiento cognitivo, el ejercicio y la dieta.
Los investigadores estiman que, en 2021, se estaban investigando en ensayos clínicos en todo el mundo un total de al menos 126 agentes diferentes, incluidos los de los estudios del NIA 9.
Como voluntario, Reiswig ha tenido que aceptar la carga especial que conlleva su ensayo en particular, no solo el compromiso de tiempo, sino también los constantes recordatorios del destino que le espera si el fármaco del ensayo no funciona. Ayuda, dice, que el consorcio DIAN reúna a participantes de todo el mundo una vez al año para compartir sus experiencias. “Hemos creado una comunidad maravillosa y sabemos que contribuimos fuertemente a la ciencia”.